Anwendung von sNfL (Serum Neurofilament Light Chain) als Biomarker der MS in der Versorgung
Bei der Behandlung der Multiplen Sklerose (MS) ist der frühzeitige Beginn und die hochwirksame verlaufsmodifizierende Therapie („disease modifying therapy“, DMT) entscheidend, um das Risiko einer Behinderungsprogression zu verringern. Daher besteht ein Bedarf an prognostischen und prädiktiven Biomarkern zur Eingrenzung und Bewertung des Erfolgs von Behandlungsstrategien.
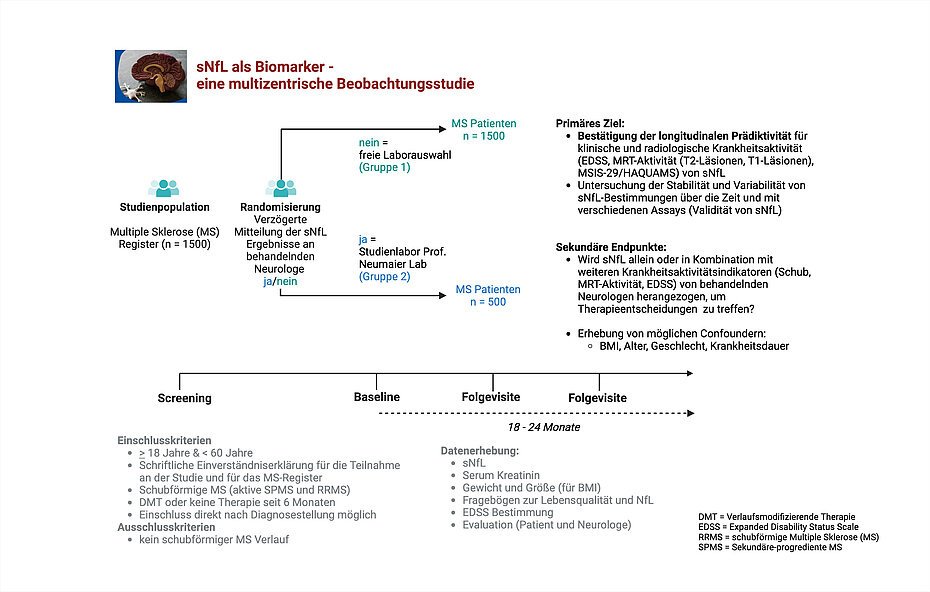
Im Rahmen dieser Studie in Zusammenarbeit mit der Charité – Berlin soll das prognostische Potenzial des Biomarkers Serum Neurofilament Light Chain (sNfL) bezüglich des Krankheitsverlaufs sowie für mögliche Therapieentscheidungen untersucht werden.
Der sNfL wurde in zahlreichen Publikationen mit klinischen und radiologischen Krankheitsparametern der MS assoziiert und die Abnahme des sNfL-Wertes unter potenter Immuntherapie gezeigt. (1) Ein zu sNfL komplementärer Biomarker-Kandidat in der MS, der besser den schubunabhängigen Progress widerspiegelt, ist glial fibrillary acidic protein (GFAP)(2) Eine Bestimmung in der klinischen Routine ist derzeit in Deutschland nicht verfügbar.
Durch die Untersuchung von sNfL werden folgende Hypothesen geprüft:
Primäre Endpunkte:
- Bestätigung des prädiktiven Werts von sNfL für klinische und radiologische Krankheitsaktivität (EDSS, MRT-Aktivität (T2-Läsionen, Hirnvolumen), MSIS-29 bzw. andere Lebensqualitätsfragebögen wie z.B. den HAQUAMS.)
- Untersuchung der Variabilität von sNfL im zeitlichen Verlauf sowie zwischen verschiedenen Assays und verschiedenen Laboren (Validität von sNfL)
Sekundäre Endpunkte:
- Wird sNfL, allein oder in Kombination mit weiteren Krankheitsaktivitätsindikatoren (Schub, MRT-Aktivität, EDSS), von behandelnden Neurologen herangezogen, um Therapieentscheidungen (Beibehaltung, Neubeginn, Therapiewechsel) zu treffen?
- Gibt es darüber hinaus schubunabhängig GFAP Veränderungen in der Zeit als Hinweis für einen schubunabhängigen Progress?
- Gibt es Unterschiede in der Diagnostik und Therapieentscheidung zwischen den Randomisierungsgruppen?
Das sNfL-Zusatzprojekt umfasst einen Zeitraum von 2 Jahren und beinhaltet 3 Visitenzeitpunkte (Basisvisite und 2 zeitlich flexible Folgevisiten über einen Zeitraum von ca. 1,5-2 Jahren pro Patient:in). Alle Studienvisiten erfolgen im Rahmen der Routine MS-Versorgung.
Aufgabe
Die Studiendokumentation erfolgt über das MS-Register. Hierfür implementiert das MS-Register die dazugehörigen elektronischen Fragebogen und stellt die technische Infrastruktur für die Primärdatenerhebung der teilnehmenden Zentren zur Verfügung . Zusätzlich unterstützt das MS-Register die teilnehmenden Zentren bei der Rekrutierung von Patientinnen.
Finanzierung
Die Studie wird von Novartis Pharma in Nürnberg unterstützt.
Studienleitung
Prof. Dr. Friedemann Paul
Charité – Universitätsmedizin - Berlin, Experimental and Clinical Research Center (ECRC), AG Klinische Neuroimmunologie, Lindenberger Weg 80, 13125 Berlin
Studienorganisation: 030 450 539 736
Rebekka.rust@charite.de
lina.bahr@charite.de
Zeitraum
Laufzeit: 24 Monate
Rekrutierungsbeginn: März 2025
Teilnehmende Zentren
Voraussetzung für die Teilnahme ist die Teilnahme an der erweiterten Dokumentation im Bereich der Pharmakovigilanz.
| Einrichtung | Standort |
|---|---|
| Universitätsklinikum Heidelberg | Im Neuenheimer Feld 400, 69120 Heidelberg |
| St. Josefs-Krankenhaus Potsdam | Allee nach Sanssouci 7, 14471 Potsdam |
| meinmedicum MVZ | Marienbader Platz 22, 61348 Bad Homburg v. d. Höhe |
| Praxis Dr. Andreas Kowalik | Leuschnerstraße 12, 70174 Stuttgart |
| Krankenhaus der Barmherzigen Brüder Trier | Nordallee 1, 54292 Trier |
| Charité – Universitätsmedizin Berlin | Charitéplatz 1, 10117 Berlin |
| Klinikum Ibbenbüren, Klinik für Neurologie | Große Str. 41, 49477 Ibbenbüren |
- 1. Khalil M, Teunissen CE, Lehmann S, Otto M, Piehl F, Ziemssen T, et al. Neurofilaments as biomarkers in neurological disorders — towards clinical application. Vol. 20, Nature Reviews Neurology. Nat Rev Neurol; 2024. p. 269–87.
- 2. Abdelhak A, Antweiler K, Kowarik MC, Senel M, Havla J, Zettl UK, et al. Serum glial fibrillary acidic protein and disability progression in progressive multiple sclerosis. Ann Clin Transl Neurol. 2024 Feb 1;11(2):477–85.